11月13日,国家药品监督管理局(NMPA)正式批准启明创投投资企业推想医疗科技股份有限公司(原北京推想科技有限公司,下称“推想科技”)的肺结节AI三类认证,这也是中国NMPA批准的第一张肺部AI三类认证。
早在2020年初,推想就以全球第一家的身份拿到胸肺CT领域AI的FDA和PMDA认证,至此,推想科技也成为全世界唯一一个拥有欧盟CE、日本PMDA、美国FDA,中国NMPA四大市场认证的AI医疗公司,获得了全球绝大部分主要医疗市场的准入资格。

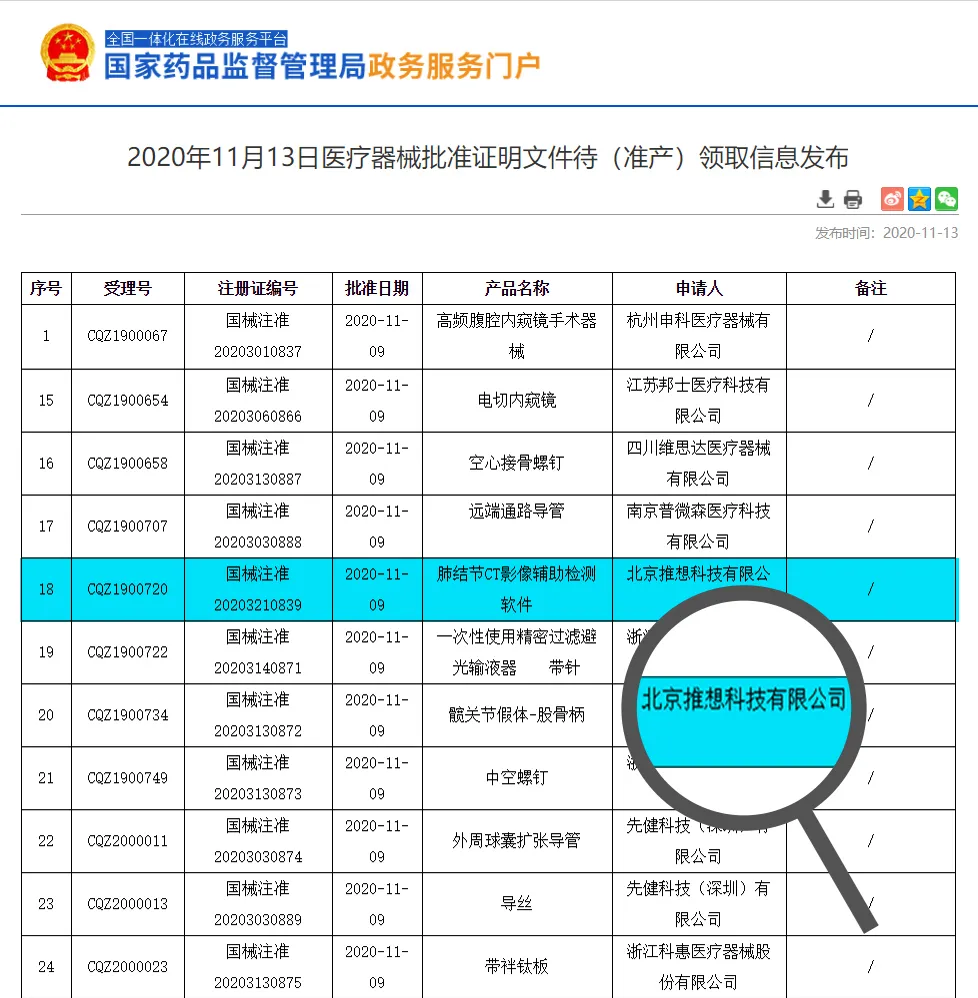
由于医疗产品事关人的生命健康,在世界各国都具有极其严格的监管措施,AI医疗行业也同样具有高准入门槛的行业属性。NMPA根据风险程度,对于医疗器械(包括医用软件)有着严格的分级管理制度。
NMPA明确指出:“诊断功能软件风险程度按照其采用算法的风险程度、成熟程度、公开程度等为判定依据,不仅仅依据处理对象(如:癌症、恶性肿瘤等疾病的影像)为判定依据。若诊断软件通过其算法对病变部位进行自动识别,并提供明确的诊断提示,则其风险级别相对较高,按照第三类医疗器械管理。”
以推想肺结节AI产品为例,由于其高度智能化、对医生提供了强大的辅助功能,属于第三类医疗器械。
推想肺结节AI产品与国内多家顶级三甲医院合作进行严格的临床试验。该试验采用MRMC(multireader multicase)的前瞻性临床设计,与国际标准对标,并且试验结果非常优异。
推想肺结节AI产品的适应症/适用范围非常广,普遍适用于不同临床场景,无症状或有症状的患者,不同年资的医师。产品的安全性、有效性、易用性、鲁棒性均非常突出。
推想肺结节AI产品进行了巨大的投入,完全符合医生的使用需求,并可以直接参与到临床诊断流程,具有明确的临床应用场景和较高的技术门槛。
肺癌的发病率和死亡率,无论全球还是中国都长期位居恶性肿瘤的首位。推想肺结节AI产品将深度学习技术用于肺结节的智能检测与筛查,将肺癌的发现与治疗时点大幅提前,让肺癌患者早诊早治,降低医疗支出,具有巨大的应用价值和推广前景。
不仅在中国,全世界尤其是美国、欧洲、日本等发达国家和地区,都对医疗产品有着严格的监管和准入门槛。这也是为什么目前人工智能医疗公司为数不少,但能够获得全球主流市场准入认证的却屈指可数。
在这样的背景下,推想科技却一枝独秀。自2020年2月以来,推想科技马力全开,陆续获得欧盟CE认证,日本PMDA认证、美国FDA认证,并拿到最具含金量的首个中国肺部AI三类认证。
医疗市场的准入门槛其实越来越高。推想能够成为中国AI医疗企业中唯一获得四大市场准入认证,足见其硬实力。推想AI是FDA批准的全世界第一款肺部CT深度学习产品。
能够同时满足四大市场的准入要求,必然进行了巨大的研发投入,是对产品能力的最好证明。此外,这四张准入认证不仅覆盖了中国、美国、欧盟、日本这四个全球最主要的、医疗水平最高、准入审核最严格的市场,也为世界其他国家和地区的市场准入提供了重要参考。
推想科技始终是中国AI医疗企业国际化的主力军,自2017年陆续成立推想日本、北美团队,2018年成立推想欧洲团队,其产品在国际上广获赞誉。
更重要的是,推想科技是为数不多在海外拥有业务团队并真正开展国际合作的AI医疗企业。目前,推想AI已经与海外超过60家医疗机构展开合作,遍布瑞士、德国、美国、加拿大、日本、法国、意大利等全球医疗水平最高的国家和地区。
