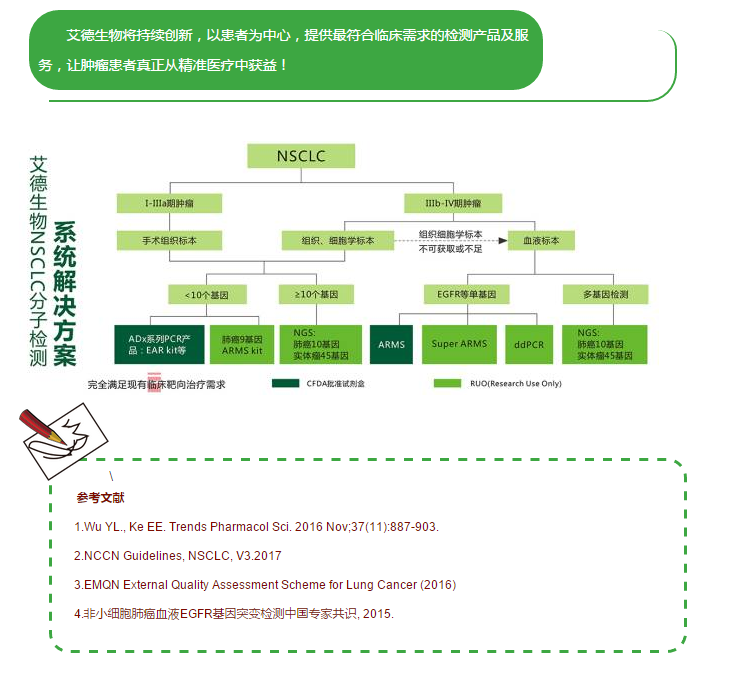
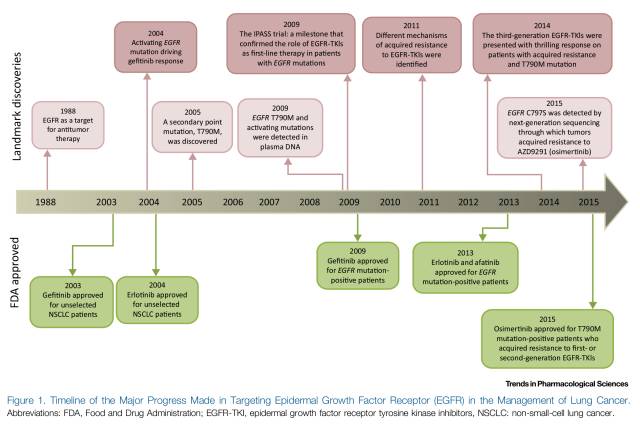
2003年,首个EGFR酪氨酸激酶抑制剂(EGFR-TKI)——吉非替尼获美国食品药品监督管理局(FDA)批准,随后却因后续数据显示无法延长患者生存而撤回;2009年,IPASS研究首次揭示了EGFR-TKIs作为一线治疗与EGFR基因突变患者的相关性,随后的研究也仅针对EGFR突变并证实在这类晚期NSCLC患者中,EGFR-TKIs疗效优于一线化疗(图1)。基于这些结果,吉非替尼、厄洛替尼也获批用于EGFR突变NSCLC的一线治疗。如今EGFR突变检测已成为全球大多数肿瘤中心的临床常规检测。此后针对一代EGFR-TKIs治疗后耐药的二代、三代EGFR-TKIs也被设计以针对继发耐药的分子机制为主,以EGFR T790M突变最为常见,并在不同的突变位点人群中表现出不同的治疗活性(图2)。


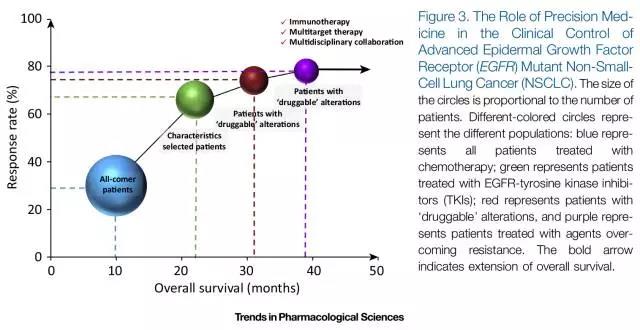
从最初的不筛选患者使用化疗方案治疗,到根据临床特征选择患者进行靶向治疗,再到根据“可治疗”基因状态筛选患者有针对性选择靶向甚至是多方案联合治疗,虽然缩小了治疗适应人群,但是针对特定人群不管是药物反应率(Response Rate)还是总生存期(Overall Survival)都有显著提高(图3)

EGFR-TKIs的耐药机制分为四类:1)EGFR耐药突变,如T790M突变,可消除吉非替尼或厄洛替尼的活性却不减弱受体激酶活性;2)旁路信号通路激活;3)组织病理学转变为小细胞肺癌;4)上皮-间质转化(EMT)。其中EGFR T790M突变最为常见,约为50%。明确耐药机制是为耐药患者制定后续靶向治疗方案的必备条件。
研究显示,肿瘤的时间及空间异质性在EGFR-TKIs耐药机制中的作用极其重要。不同的耐药机制可以表现为治疗前已经存在的突变克隆或者长期治疗过程中逐渐凸显的突变克隆,即时间异质性;也可以表现在同一患者不同病灶中,即空间异质性(图4)。

第三代EGFR-TKIs针对T790M突变NSCLC的有效性,促进了对EGFR-TKIs继发耐药患者重复活检的研究。但是重复活检对用于明确耐药机制的应用仍存在挑战,因肿瘤部位或个人意愿因素使得部分患者无法实现重复活检。尽管在近期某项评价血浆检测T790M突变的研究中,循环肿瘤DNA(ctDNA)检测与组织活检一致性仅61%,但另有35%患者被检出T790M阳性,这说明某种程度上ctDNA检测可以抵消肿瘤异质性的影响。
ctDNA检测在临床上可应用到四个层面:1)作为无法获取组织时的替代;2)ctDNA中EGFR突变状态的动态变化可能提示肿瘤病情变化和预后;3)动态监测治疗过程中耐药突变T790M的出现与否;4)用于探索第三代EGFR-TKIs继发耐药机制。
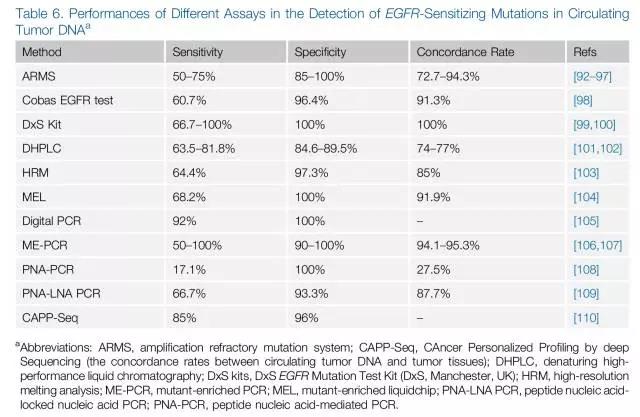
关于ctDNA的检测方法五花八门,检测准确性参差不齐,敏感性和特异性浮动较大(图5)。ARMS技术特异性高,但敏感性使其临床应用受限;数字PCR和NGS敏感性和特异性高,但仍需要继续积累技术经验及临床数据。如果能解决敏感性与特异性的问题,ctDNA的无创、简便的优势将使其在肿瘤治疗监测过程中扮演重要角色。
![]()
无论是靶向抑制剂的选择还是耐药后治疗方案制定都与靶基因状态密切相关,因此治疗之前明确“可靶向”基因的状态对于肿瘤患者来说至关重要。如今,随着“精准医学”概念的兴起,肿瘤相关的可检测基因纷涌而出,各种基因检测套餐层出不穷,尤其是NSCLC。对于NSCLC患者来说,究竟哪些基因才是在治疗前真正需要且必要被检测的呢?
近期,美国癌症联盟(NCCN)发布了2017版NSCLC临床实践指南,新版NCCN指南在晚期NSCLC治疗流程及一线治疗进展后的处理上都体现出靶向诊疗在NSCLC上的新进展。
晚期NSCLC治疗前应检测EGFR/ALK/ROS1
随着ROS1基因融合靶向药物临床取得了振奋人心的研究结果, FDA于今年3月批准了克唑替尼用于治疗ROS1阳性的转移性NSCLC,为NSCLC治疗带来了新的选择。基于此,2017版NCCN指南首次将ROS1基因融合检测纳入晚期NSCLC一线治疗流程中,明确了NSCLC治疗前应检测EGFR/ALK/ROS1单个基因状态的临床要求(图6)。


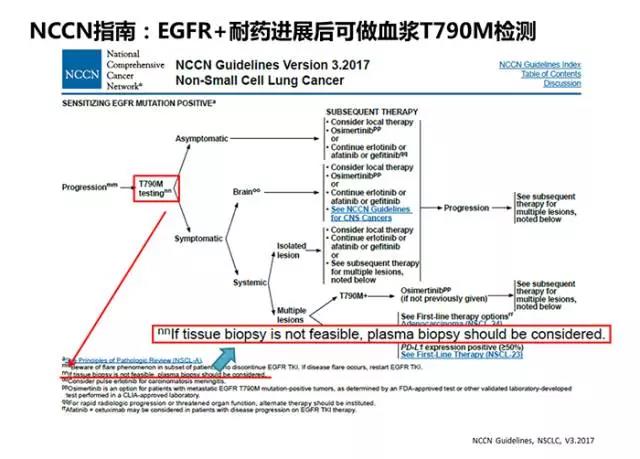
一代EGFR-TKIs一线治疗后继发耐药机制中,T790M突变约占50%,第三代EGFR-TKIs问世标志着EGFR T790M突变的NSCLC继发耐药患者的后续治疗有了突破性进展。2015年11月FDA加速批准了Osimertinib(AZD9291)用于治疗EGFR T790M突变的、在EGFR TKI治疗时或治疗后进展的转移性NSCLC。因此,2017版NCCN指南推荐EGFR-TKIs一线治疗进展后应检测T790M突变,且当组织活检标本不可获取时可考虑选用血浆标本进行检测(图7)。

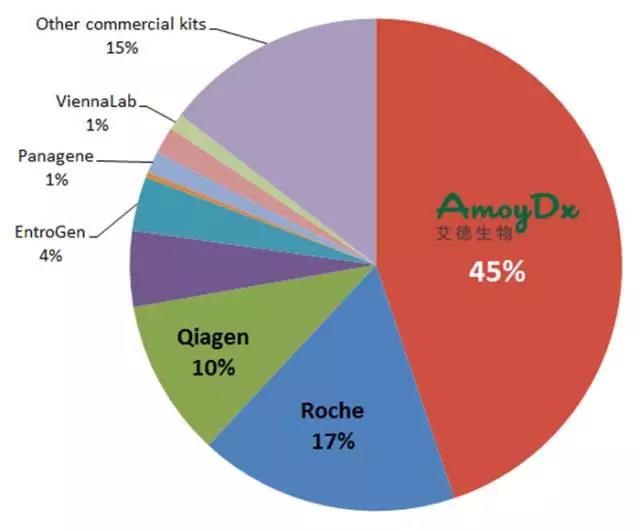
基因检测技术日新月异,不同技术在不同的应用场景中各有优劣,因此应充分考虑肿瘤中基因变异的稀有性、异质性等特点,针对被检标本性质及被检基因数量等因素,选择最合适的检测技术。NSCLC靶基因众多,突变丰度跨度大,ARMS法灵敏度高、快速准确,能覆盖现有临床确证的绝大部分基因,是目前临床应用最为广泛的技术。
同时,对于医生及患者而言,基因检测结果的准确和可靠尤为重要,因此应选择经国家食品药品监督管理总局(CFDA)审批上市的产品。
艾德生物专注于肿瘤精准医疗分子诊断领域,基于自主研发的ADx-ARMS®核心技术研发的针对EGFR、ALK、ROS1、KRAS、NRAS、BRAF、PIK3CA等基因的13种目前在肿瘤基因检测领域最重要的单检或联检试剂产品率先获得CFDA《医疗器械注册证》和欧盟CE认证。
EMQN质评:艾德生物系列产品连续三年使用率蝉联第一
2014-2016年,艾德生物在欧洲分子基因诊断质量联盟(EMQN)的室间质评活动中,凭借其优异的产品性能及广泛的使用范围,获得应用单位的高度认可,产品使用率连续三年保持第一!

今年1月,艾德生物自主研发的EGFR/ALK/ROS1基因突变联合检测试剂盒获得CFDA《医疗器械注册证》,是国内唯一获批可同时检测EGFR、ALK、ROS1三基因的试剂产品。基于广泛应用的PCR平台及升级的检测技术,该试剂盒操作更加简便、快捷,且适用新鲜组织及活检、细胞学等小标本。配套艾德生物DNA/RNA共提取试剂产品,当天即可完成从核酸提取、上机检测到出具报告的全部流程,大大缩短临床诊疗等待时间,为NSCLC临床诊疗真正实现EGFR/ALK/ROS1三基因同步检测。


2015年12月发表的《非小细胞肺癌血液EGFR基因突变检测中国专家共识》作为中国首个相关专家共识,规范了中国肺癌患者血液EGFR突变检测,明确建议:1)使用专用常温采血管采集全血;2)采用国家药监部门批准的、大容量血浆游离DNA分离试剂盒;3)检测方法必须使用经CFDA批准的检测试剂盒,目前最常用的方法仍是ARMS法。
基于ADx-ARMS®技术,艾德生物研发的EGFR基因突变检测试剂盒是目前国内唯一一个获CFDA批准可用于临床血液EGFR检测的ARMS法检测试剂盒。配套艾德专用常温采血管及循环DNA提取试剂盒(4mL血浆上样),完全符合专家共识建议,为临床提供血液EGFR检测标准化解决方案。